
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z

Anions : ions, dont les éléments appartiennent aux dernières colonnes de la classification périodique de Mendeleïev, et qui ont plutôt tendance à capter des électrons pour donner des espèces chargées négativement (tels que Cl-…).
Angström : unité de longueur employée en microphysique, valent un dix-millième de micron soit 10-10 m. Elle a pour notation Å.
Angström, Anders Jonas (1814-1874) : astronome et physicien suédois.
Arborescence : forme naturelle ressemblant à des végétations, à des ramifications.
Atome : espèce chimique électriquement neutre constituée d'un noyau chargé positivement et d'électrons.

Boltzmann, constante de : constante fondamentale de physique classique et quantique, notée k. Elle intervient dans l'équation d'état d'un gaz parfait : PV = nkT, où P est la pression, V le volume, n le nombre de molécules du gaz et T la température du gaz. La constante k, dont le nom fait référence au physicien autrichien Ludwig Boltzmann, est donnée par : k = R/N, R étant la constante des gaz parfaits, N étant le nombre d'Avogadro ; k = 1,380.10-23 J/K.
Bravais, Auguste (1811-1863) : botaniste, physicien, astronome et minéralogiste français, connu pour sa théorie sur la structure en réseaux des cristaux. Il entreprend des études sur les cristaux dont il soumet les résultats à l'Académie des sciences entre 1845 et 1848, puis les publie en 1866 dans un ouvrage intitulé Études cristallographiques. Dans cet ouvrage, il étudie mathématiquement les structures réticulaires (en réseaux), et en déduit quatorze arrangements possibles de points dans l'espace. Puis, appliquant cette approche mathématique à la cristallographie, il propose une théorie selon laquelle les cristaux sont organisés en réseaux d'atomes ou d'ions disposés régulièrement et formant par leur arrangement quatorze types de réseaux différents, appelés depuis lors réseaux de Bravais. La théorie de Bravais sera confirmée en 1911 par les études de von Laue sur la diffraction des rayons X par les cristaux.

Cations : ions, dont les éléments appartiennent aux premières colonnes de la classification périodique de Mendeleïev et qui ont plutôt tendance à perdre des électrons pour donner des espèces chargées positivement (tels que Na+…).
Compacité : valeur liée à une maille définie comme le rapport du volume occuppé par les ions sur le volume total de la maille. Voir aussi Compacité d'une maille.
Coordinence : nombre de voisins immédiats d'un ion (également appellé nombre de coordinence"). Pour plus de renseignement, voir la page sur la Coordinence des ions.
Covalence (liaisons de) : liaison dans laquelle une orbitale moléculaire est occupée par deux électrons, venant chacun d'un des deux atomes liés.
Cristal ionique : cristal composé d'ions et dont chaque ion positif est entouré par des ions négatifs et chaque ion négatif est entouré par des ions positifs.
Cristallogenèse : formation d'un cristal.

Dévitrification : cristalisation du verre sous l'action de la chaleur, conduisant à une perte de transparence.
Duet (règle du) : les atomes proches de l'hélium évoluent pour acquérir deux électrons externes et ainsi avoir leur couche externe remplie.

Électron : particule chargée négativement, élément constitutif de l'atome de masse égale à 1/1836 de la masse du proton (soit 9,10953.10-31 kg) et de charge valant -1,602.10-19 C (l'opposée de celle du proton).
Électronégatif : se dit d'un élément ayant tendance à attirer et à capter des électrons.
Électronégativité : capacité d'un élément à attirer vers lui les électrons d'un doublet liant. Sur le tableau périodique des élements, les éléments les plus électronégatifs sont en haut à
droite et les moins électronégatifs sont en bas à gauche.

Électropositif : élément ayant tendance à perdre des électrons.
Entropie : grandeur extensive définie par tout système physique, dont l'existence découle du deuxième principe de la thermodynamique et qui ne décroît jamais au cours d'un processus naturel. Elle est définie sous forme différentielle par dS = dQ/T.
Enthalpie : en thermodynamique, fonction définie par la somme de l'énergie interne d'un système et du produit de sa pression par son volume. Dans une transformation chimique à pression constante, la variation d'enthalpie est égale à la quantité de chaleur dégagée.
Exothermique : qui produit de la chaleur.

Frittage : vitrification préparatoire incomplète de certains matériaux, afin d'accélérer le processus de fusion qui produit de la chaleur.

Gemme : cristal d'une grande pureté. Sa particularité est d'avoir une symétrie cubique et une solubilité athermique.

Haber : Chimiste allemand (Breslau, 9/12/1868 - Bâle, 29/01/1934), Prix Nobel de chimie en 1918.
Halite : synonyme de sel gemme.
Halogène : chacun des éléments chimiques faisant partie de la colonne VII de la classification périodique de Mendeleïev.
Halogénure : sel ou ester obtenu par combinaison d'un halogène avec un autre élément.
Haüy, abbé René Just (1743-1822) : minéralogiste français,
né à Saint-Just-en-Chaussée (Picardie). Il a posé les bases de la
cristallographie moderne. Il émit la théorie selon laquelle le cristal est
composé de très petites unités identiques, et que la disposition des
facettes d'un cristal selon des angles différents explique les différences
observées dans ses propriétés. Ordonné prêtre, Haüy devint botaniste et
plus tard cristallographe.

Hygroscopique : qui absorbe l'humidité de l'air.

Indices de Miller : il s'agit de trois nombres entiers qui permettent de déterminer un plan nodal ou une rangée nodale. Voir aussi Indices de Miller.
Ions : atomes qui ont gagné ou perdu un ou plusieurs électrons.
Isotopes : chacun des éléments de même numéro atomique occupant la même place dans la classification périodique de Mendeleïev mais de masse atomique différente.


Kelvin : unité de mesure thermodynamique de température (symbole K). Le kelvin est défini comme la fraction de 1/273,16 de la température du point triple de l'eau. la température du zéro kelvin correspond au zéro absolu, soit -273,16 °C.

Liaison de covalence : voir Covalence (liaisons de).
Loi de la thermodynamique : voir Thermodynamique, première loi de la.

Maille : on appelle maille toute portion du réseau dont la juxtaposition périodique reproduit le réseau. On appelle maille élémentaire, une maille de la plus petite dimension possible (pour le réseau considéré). C'est généralement elle que l'on représente et le mot maille est le plus souvent utilisé pour la désigner. Une maille rend compte de l'agencement des ions dans le cristal. Chaque maille possède trois paramètres de dimensions et trois paramètres d'angles qui, avec le réseau auquel elle appartient, permet de la définir. Voir aussi Les mailles.
Mendeleïev, Dimitri Ivanovitch (1834-1907) : Chimiste russe
inventeur, en 1869, de la classification qui porte son nom. Il
eut l'idée de cette classification lors de la rédaction d'un ouvrage
d'enseignement de la chimie. Confronté au délicat problème de la
classification des éléments, il proposa une répartition dans un tableau où
le classement se fait par ordre de masse atomique croissante et en plaçant
dans les colonnes les éléments par propriétés similaires. Mieux que de se
contenter de classer les éléments, il prédit même les propriétés d'un
certain nombre d'éléments alors encore non découverts. Son travail novateur
ne sera reconnu que vingt ans plus tard, en 1889. En 1893, il devint
directeur du Bureau des poids et mesures de Saint-Pétersbourg et occupa ce
poste jusqu'à sa mort.

Monocristal : visible par la diffraction aux rayons X, il correspond à la croissance dans les trois dimensions des prolongements de la maille élémentaire sans discontinuité. Ainsi une aiguille de cristaux de sel est un monocristal.
Motif : le motif d'un réseau est ce qui est situé à chaque nœud du réseau. Dans le cas d'un cristal ionique le motif est constitué d'au moins deux ions. Pour le NaCl par exemple, le motif est constitué d'un ion Na+ et d'un ion Cl-.

Neutrons : particule élémentaire, électriquement neutre, qui fait partie de tous les noyaux atomiques sauf celui de l'hydrogène normal (isotope le plus présent). C'est le nombre de neutrons qui différencie les noyaux des isotopes.

Octet (règle de) : les atomes évoluent pour acquérir
huit électrons sur leur couche externe.
Ces évolutions aboutissent à des molécules ou à des ions.
Organominéral : substance complexe formée d'oligoéléments, ou d'éléments métalliques (métalloïdes) présents à l'état de traces dans les organismes vivants (iode, fluor, fer, zing, brome, aluminium, silicium, cuivre, manganèse, cobalt, …). Exemples d'organomineraux : hormones tyroïdiennes, certains engrais, …

Plan nodal : c'est un plan passant par plusieurs nœuds d'une maille. Un plan nodal est déterminé par ses indices de Miller. Voir aussi Plans nodaux.
Polarité : quand une liaison est établie entre deux
éléments chimiques (ions ou atomes) et que ceci ne sont pas indentiques, l'élément qui possède
la plus forte électronegativité attirera plus fortement les
électrons vers lui. Le nuage électronique ne sera plus symétrique et les charges électriques
ne seront plus situées au centre des deux atomes. On dit d'une telle liaison qu'elle est
polarisée, car elle agit comme si elle possédait un pôle positif et un pôle négatif. On dit
aussi qu'elle possède des charges électriques partielles positives et négatives. La polarité
d'une molécule peut être à l'origine de sa courbure : par exemple la molécule d'eau qui
est polaire est coudée tandis que la molécule de dioxyde de carbone est droite. Une liaison
polaire ne peut pas être 100% covalente, mais posséde un certain caractère ionique. Toutefois,
il faut se rappeler que même dans une liaison très polaire, par exemple Na+ et
F- qui est la plus polaire imaginable, les charges partielles ne sont que ± 0,9. Voici une illustration montrant le nuage électronique d'une laison polaire (ici H-Cl) :

Polymorphisme : faculté d'une substance chimique à cristalliser en plusieurs structures différentes en réponse aux changements de pression et/ou de température. Les structures différentes d'une telle substance chimique sont connues comme étant des polymorphes.
Protons : particule élémentaire constitutive du noyau atomique, de charge électrique positive égale numériquement à celle de l'électron mais de masse 1840 fois plus grande (voisine de celle du neutron).


Rangée nodale : c'est une droite passant par plusieurs nœuds d'une maille. Une rangée nodal est déterminé par ses indices de Miller. Voir aussi Rangées nodaux.
Rayon ionique : voir la partie sur les Rayons ioniques.
Réseau : c'est un ensemble de points (ou nœuds) de l'espace caractérisé par périodicité. Quand on parle du réseau d'un cristal on désigne la plus petite partie de ce réseau qui en possède les symétries et qui répétée à l'infini permet de reconstituer le cristal tout entier. Il diffère cependant de la maille en ce sens qu'un point (ou nœud) du réseau n'est pas un ion mais un assemblage d'au moins deux ions liés entre eux (par exemple pour le cristal de NaCl un nœud représente un assemblage d'un ion Na+ et d'un ion Cl-. Voir aussi Les réseaux.
Réseaux de Bravais : au nombre de quatorze, ils correspondent aux différents agencements possibles des motifs d'un cristal. Chaque réseau de Bravais appartient à un des sept systèmes cristallins. Voir aussi Les quatorzes réseaux de Bravais.

Saturation : concentration maximale d'un soluté dans un solvant. Lorsqu'on est à saturation, on ne peut plus dissoudre un soluté à une température et une pression déterminées.
Site : dans une maille, espace laissé libre entre plusieurs ions. Ils existe deux types de site : les sites tétraédriques situés au centre d'un tétraèdre de base et les sites octaédriques existant entre 6 ions appartenant à deux plans successifs.
Sursaturation : quand une solution est sursaturée, la concentration en soluté dans le solvant est supérieure à la solubilité. Le soluté à alors tendance à se remettre à l'état solide pour que la solution ne soit plus sursaturée.
Solubilité : proportion de substance qui peut être dissoute dans une masse, un nombre de moles ou un volume donné de solvant, à saturation, pour une température et une pression déterminée.
Solvant : substance le plus souvent liquide qui a le pouvoir de dissoudre d'autres substances. Constituant d'une solution dans laquelle a été dissous un soluté. Le solvant le plus connu et le plus utilisé est l'eau.
Solvatation : agencement d'une molécule avec un solvant.
Sublimation : épuration d'un corps solide qu'on transforme en vapeur en le chauffant. Passage d'un corps de l'état solide à l'état gazeux sans passage par l'état liquide.
Structure électronique : organisation des électrons autour
d'un atome ou d'un ion dans des couches.
Les couches se notent par des lettres (K, L, M, N, O, P, Q). Les premières
couches sont les plus près du noyaux. Chaque couche peut se diviser en
quatre sous-couches nommées s, p, d, f.
| Couche | K | L | M | N | O | P | Q |
| Nbre maximum d'électrons | 2 | 8 | 18 | 32 | 32 | "18"> | "8"> |
| Sous-couche | s | p | d | f |
| Nbre maximum d'électrons | 2 | 6 | 10 | 14 |
Il y a deux façons de noter une configuration électronique :
de la forme (K)2(L)8(M)7
ou de la forme Ne 3s2 3p5, Ne (le gaz rare
directement précédent dans le tableau périodique) indique que pour les
couches précédentes elles sont complétées, comme pour le Néon (Ne).
Lorsque deux atomes s'assemblent, ils tentent de compléter leur couches.
Dans le cas d'une liaison covalente (comme pour H2O) les atomes
mettent leurs électrons en commun pour compléter leur couches.
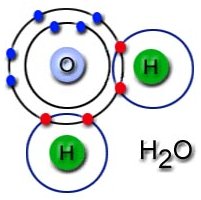
Dans le cas d'un assemblage d'ions (comme pour NaCl) il y a transfert d'un
ou plusieurs électrons.

Substitution ionique : remplacement d'un ion par un autre sans changement de constitution.
Systèmes cristallins : tout cristal adopte une configuration spatiale qui suit l'un des sept systèmes cristallins. Ils ont étés découverts par René Just Haüy mais ce fut Auguste Bravais qui montra qu'il n'y en avait que sept. Chaque système est un prisme définit par trois paramètres de dimensions qui correspondent aux tailles des arêtes et trois paramètres d'angles qui correspondent aux angles formés par les arêtes. Chaque système comporte un ou plusieurs réseaux de Bravais différents. Voir aussi Les sept systèmes cristallins.

Thermodynamique : branche de la physique qui étudie tous les phénomènes dans lesquels interviennent des échanges thermiques.
Thermodynamique, première loi de la : elle dit que l'énergie d'un système isolé est constante, ou encore qu'au cours d'un processus quelconque, l'énergie peut changer de forme, mais ne peut être ni créée, ni détruite.


Valence d'un atome : nombre de ses électrons célibataires.
Van der Wals : Physicien néerlandais (Leyde, 1837 – Amsterdam, 1923). Il fut celui qui améliora la loi d'état des gaz parfaits. On doit également à Johannes Van der Waals des travaux sur la dissociation électrolytique ainsi qu'une théorie thermodynamique de la capillarité. Il fut élu à l'Académie royale des sciences et des lettres des Pays-Bas en 1875. En 1910 il reçut le prix Nobel de physique.
Vitrification : action de transformer en verre.



