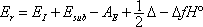I - Dissolution dans un solvant (eau)
II - Variations d'énergie lors de la dissolution
Les molécules d'eau, polaires, exercent sur le cristal des forces électriques qui dissocient le cristal ionique. Les deux étapes précédentes : dissociation du cristal en ions séparés et solvatation des ions, sont suivies de la dispersion des ions solvatés dans tout le volume occupé par le liquide.
Remarque : Le phénomène de solvatation des ions, dû à l'interaction ion-dipôle, est général et d'autant plus accentué que l'ion est petit et que sa charge est élevée.
L'atome d'hydrogène H est formé d'un noyau (ne comportant qu'un seul proton positif) et d'un électron négatif. L'ion H+ est donc un proton. Cet ion est très petit. Il forme avec l'eau une liaison très forte qui permet de considérer l'ion H+(aq) comme l'espèce H3O+, appelée ion oxonium (plutôt que hydronium). Cet ion H3O+, présent dans une solution aqueuse, lui confère des propriétés acides.

Notations :
- Une solution aqueuse de chlorure de sodium est notée
Na+(aq) + Cl-(aq). On tolère l'écriture
(Na+ + Cl-) mais en aucun cas NaCl qui désigne le
solide ionique chlorure de sodium et non la solution aqueuse correspondante.
- La notation (s) désigne un solide. La notation (l) désigne
un liquide. La notation (g) désigne un gaz.
Cas du solide ionique NaCl :
L'équation de dissolution (ou dissolution) s'écrit sous cette forme :
NaCl(s) = Na+(aq) + Cl-(aq) ou plus simplement :
NaCl(s) = Na+ + Cl-
Pour rappeler que les ions Na+ et Cl- sont solvatés (liés à des molécules d'eau) on les écrira souvent Na+(aqueux) et Cl-(aqueux) ou, plus simplement, Na+(aq) et Cl-(aq).
Il faut atteindre une température élevée (température de fusion tF = 801 °C pour le NaCl) pour que le solide cristallin fonde en donnant un liquide dans lequel les ions sont devenus mobiles. Par contre, c'est à la température ordinaire (dans les CUTP ou Conditions Usuelles de Température et de Pression, soit à 25 °C et à la pression atmosphérique de 1013 hPa), que la dissolution du chlorure de sodium dans l'eau se produit.
Les énergies mises en jeu dans la dissolution d'un solide sont :
– L'énergie de cohésion du solide : on doit fournir de l'énergie
pour vaincre cette cohésion. Dans le cas d'un solide ionique comme un sel
alcalin, par exemple NaCl, l'enthalpie
de sublimation du solide mise en jeu, n'est rien d'autre que -U, où U est
l'énergie de réseau du solide.
Dans le cas d'un solide moléculaire qui, en se dissolvant, donne des
molécules avec liaisons covalentes,
l'interaction entre ces unités covalentes du solide étant du type
Van der Waals, l'énergie requise pour vaincre
la cohésion du solide est faible.
– L'énergie de solvatation :
elle est présente lors de l'attraction entre les entités dissoutes, porteuses
soit de charges ioniques ou de dipôles induits, et les molécules plus ou
moins polaires du solvant.
La solvatation est toujours exothermique,
et son enthalpie toujours négative. Elle est de grandeur comparable à
l'énergie de cohésion de cristaux ioniques et peut ainsi permettre leur
dissolution. Elle est faible dans le cas de la solvatation de molécules
covalentes issues d'un solide moléculaire, mais là aussi elle est
généralement plus importante que l'énergie de cohésion associée aux forces
de Van der Waals.
– L'énergie de changement de structure du solvant : pour
que les molécules de solvant puissent s'attacher aux entités dissoutes dans
le processus de solvatation, et pour que les molécules de soluté puissent
même s'insérer dans la structure "molle" qui prévalait dans le
solvant,
il faut dissocier cette structure, aussi non-rigide soit-elle. Ceci demande
une certaine énergie. C'est la grandeur de cette énergie qui régit surtout
la solubilité des solides moléculaires.
Elle limite la solubilité de composés covalents non-polaires.
Dans le cas de composés polaires, les forces de cohésion dans le
solide et les interactions soluté/solvant (énergie de solvatation) sont plus
grande. Cette énergie liée au changement de structure du solvant devient
moins importante, et la solubilité augmente. L'énergie de changement de
structure du solvant est négligeable dans le cas des solides ioniques,
étant complètement dominée par les deux premiers type d'énergie.

l'eau, molécule polaire
Pour illustrer l'effet des différentes forces en jeu, considérons la dissolution d'un cristal ionique, tel (Na+ + Cl-) dans l'eau.
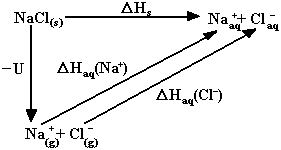
Ce cycle de Hess illustre comment les différentes quantités énergétiques interviennent. On y distingue deux contributions à l'enthalpie de solvatation : celle associée aux cations et celle associée aux anions.
L'énergie d'hydratation des ions est gouvernée par l'interaction électrostatique entre les ions porteurs de charges et les dipôles associés aux molécules de solvant. En général, la force d'interaction entre les ions et les molécules de solvant augmente avec la charge des ions et est inversement proportionnelle à leur taille. L'énergie de réseau U (c'est à dire l'addition de toutes les énergie misent en place pour la cohésion du solide) et les énergies de solvatation sont du même ordre de grandeur, et il est difficile de prédire le signe que prendrait leur différence, donc la solubilité du sel, du point de vue de la première loi de la thermodynamique (DU = Dw + DQ).
Il y a cependant deux facteurs qui jouent un rôle déterminant dans ces considérations énergétiques :
– L'effet de la charge ionique : quand celle-ci augmente, toute autre valeur étant maintenue constante, U augmente.
– La polarisabilité des ions : des interactions ion/dipôle additionnelles peuvent être induites au sein du solide et entre les ions et les molécules de solvant. Cet effet apparaît généralement plus important au sein du solide. La présence de cations polarisants conduit donc à une diminution de la solubilité.
Du point de vue entropique, le passage des ions de leur arrangement ordonné (solide cristallin) à un état solvaté, plus désordonné, fait augmenter l'entropie. D'autre part, la solvatation étant une organisation locale des molécules autour des ions, elle tend à faire diminuer l'entropie.
En général, le bilan entropique favorise la dissolution du solide cristallin ; il peut devenir défavorable cependant dans les cas où les ions sont petits, porteurs d'une densité de charge élevée, car ils auront tendance d'être plus fortement solvatés, attirant et ordonnant un plus grand nombre de molécules de solvant autour d'eux. Cependant, il faut aussi de l'énergie pour dissoudre un solide cristallin.
La stabilité d'un cristal est caractérisée par son énergie réticulaire Er = DrU°. L'énergie réticulaire est l'énergie nécessaire pour décomposer une mole d'un solide cristallisé en ses constituants en phase gazeuse. Plus Er est important, plus le solide est stable.
La technique la plus courante pour calculer l'énergie réticulaire consiste à réaliser un cycle dit de Born-Haber.
L'energie réticulaire est une énergie interne DrU° définie à T = 0 K.
Deux remarques s'imposent :
1. L'énergie interne standard réticulaire varie peu avec la
température, on pourra donc considérer :
Er = DrU° (0 K) = DrU° (298 K)
2. L'énergie interne réticulaire est très peu différente de l'enthalpie
interne standard réticulaire. On peut donc considérer :
Er = DrH°(298 K)
Voici deux exemples de valeurs pour Er :
| Symbole du cristal | Er (kJ/mol) |
| NaCl | 764 |
| MgO | 3908 |
Nous traiterons l'exemple classique du chlorure de sodium. La réaction où l'énergie réticulaire est mise en jeu est la suivante :
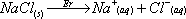
Pour déterminer sa valeur, on réalise un cycle se basant sur la réaction correspondant à l'énergie interne standard de formation :
Quelques définitions nécessaires pour construire le cycle :
– L'énergie standard de dissociation ou énergie standard de liaison (D°) est définie comme étant l'énergie nécessaire pour casser une liaison entre deux atomes. Pour le dichlore on a DdissU° = D°(Cl2) = 238,4 kJ/mol.
– L'énergie standard de sublimation (DsublimU°) est définie comme étant l'énergie nécessaire pour sublimer une mole du constituant. Dans le cas du sodium : DsublimU° 105,7 kJ/mol.
– L'énergie standard de formation (DfU°) est définie comme étant l'énergie nécessaire pour former un constituant à partir de ses éléments pris dans leur état de référence (corps pur le plus stable à la température considérée, ici 298 K). Dans le cas du chlorure de sodium : DfU° = -413 kJ/mol

Bilan du cycle :
 ou plus simplement
ou plus simplement