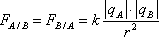
où k = 9.109 S.I. dans le vide ou dans l'air, où se trouve le vecteur unitaire dirigé de A vers B.
1 ) Interaction électromagnétique
2 ) Les liaisons Van der Waals
La cohésion d'un cristal ionique est assurée par :
Il existe d'autres interactions comme celle de la gravité. Mais elles sont négligeables à cette échelle de la matière. En effet, la gravité est proportionnelle à la masse et à l'échelle atomique les masses sont infimes.
L'interaction électrique de Coulomb n'est qu'un cas particulier de l'interaction électromagnétique, où les charges sont immobiles les unes par rapport aux autres.
Les charges de même signe se repoussent. Les charges de signe contraire s'attirent.
Loi de Coulomb : Deux objets ponctuels A et B, séparés par une distance r et portant des charges qA et qB, exercent l'un sur l'autre une force attractive (si qA et qB sont de signe contraire) ou répulsive (si qA et qB sont de même signe), dirigée suivant la droite qui les joint. Cette force varie proportionnellement au produit de leurs masses et à l'inverse du carré de la distance qui les séparent.
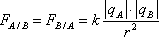
où k = 9.109 S.I. dans le vide ou dans l'air,
où se trouve le vecteur unitaire dirigé de A vers B.
Remarque : Sous forme vectorielle, on écrit :
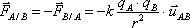 où
où  est le vecteur unitaire dirigé de A vers B.
est le vecteur unitaire dirigé de A vers B.
La charge élémentaire est e = 1,603.10- 19 C (Coulomb). Toute charge électrique est un multiple de cette charge élémentaire. À l'intérieur du noyau se trouvent des neutrons et des protons. D'après la loi de Coulomb les protons se repoussent et devraient faire éclater le noyau. Si le noyau est stable, c'est qu'entre les nucléons qui le constituent s'exerce un nouveau type de force attractive : l'interaction forte. L'interaction forte est aussi responsable des réactions nucléaires (réacteurs, bombes, étoiles comme le Soleil).
Cette interaction forte est de 100 à 1000 fois plus forte que la force électrique mais son rayon d'action est très petit, de l'ordre de 10-15 m (dimension du noyau).
C'est la plus intense des interactions connues.
Un atome est dans son état le plus stable quand sa couche de valence est la même que celle du gaz rare le plus proche (règle de l'octet) ; il va donc tenter d'acquérir cette structure électronique par perte, gain ou mise en commun d'électrons. Ces différents processus vont permettre aux atomes de se lier entre eux et conduire aux différentes liaisons chimiques.
C'est une liaison basée sur la perte ou le gain d'électron(s) afin
de compléter les couche électroniques externes (voir
Structure électronique) et ainsi
devenir stable. Cette liaison est non-dirigée, résultant de l'attraction
électrostatique, de forte intensité. L'architecture atomique doit respecter :
- l'équilibre électrostatique des charges, formant donc un ensemble
électriquement neutre
- la taille des ions, formant donc un ensemble le plus compact possible à
différentes géométries
Les solides formés par cette liaison sont appelés solides ioniques. C'est
un assemblage d'ions positifs et négatifs, alternés et imbriqués (par
exemple CsCl, NaCl, ZnS, etc…). On y associe une énergie réticulaire
élevée, entraînant des points de fusion élevés, une non-conduction de
l'électricité à l'état solide mais une forte conductivité à l'état fondu (ou
dissous) ainsi qu'une grande solubilité
dans les solvants polaires pour
certains (NaCl dans l'eau par exemple).
Les principales géométries rencontrées sont de deux types :
- NaCl : réseau c.f.c. (cubique faces centrées) de Cl- et
Na+ dans les sites octaédriques, ce qui entraîne 2 réseaux c.f.c.
imbriqués l'un dans l'autre
- CsCl : réseau c.c. (cubique centré) de Cl- et Cs+
au centre du cube
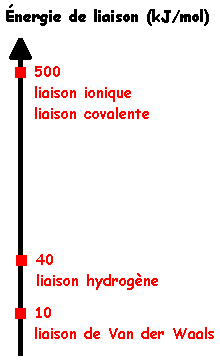
Ce sont des liaisons, de nature électrostatique, s'exerçant entre des atomes ou molécules polarisés (dipôles permanents ou induits). Il s'agit d'une attraction mutuelle des molécules. Les forces de Van der Waals sont d'autant plus intenses que le nuage électronique de l'atome ou de la molécule est grand. La plus forte des forces de Van der Waals est la liaison hydrogène.
D'après la loi des gaz parfaits, PV = nRT (où P est la pression, V le volume, n la quantité de matière, R la constante des gaz parfaits valant 8,31 J/K.mol et T la température). Le terme de pression P qui intervient dans l'équation d'état d'un gaz est, de façon rigoureuse, la pression qui confine les molécules dans le récipient de volume V. En l'absence d'interactions, cette pression est identique à la pression appliquée à l'extérieur du récipient, Pext. Les forces d'attraction entre molécules sont doublées d'une pression "intérieure", Pint, qui réduit la pression extérieure nécessaire pour maintenir le gaz dans le volume V.
La pression que subit le gaz lui-même est P = Pext + Pint.
L'équation d'état de Van der Waals s'obtient finalement en remplaçant P par (Pext + Pint) :
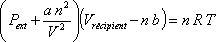
En pratique, on écrira P au lieu de Pext mais en se souvenant que cela représente la pression extérieure imposée au gaz, telle qu'un expérimentateur peut la mesurer à l'aide d'un piston, par exemple. On écrira aussi V au lieu de Vrécipient pour représenter le volume total du récipient.
C'est la plus intense des forces intermoléculaires : en effet, l'atome d'hydrogène étant très petit, il peut s'approcher tout près d'une autre molécule. C'est une forme particulière d'attraction dipôle-dipôle. La petitesse de l'atome d'hydrogène entraîne une forte polarisabilité (attraction forte vis à vis d'atomes électronégatifs des molécules voisines).
Une liaison hydrogène s'établit entre un atome d'hydrogène, lié par liaison covalente à un atome très électronégatif (F, O, N, Cl) et un autre atome, lui aussi électronégatif, possédant au moins un doublet non liant.
Les cristaux moléculaires formés par des liaisons de faible intensité, sont rompus facilement par une augmentation de l'agitation thermique (température).
En conséquence directe les températures de fusion de ces solides sont souvent basses (ils sont généralement liquides dans les conditions normales (CUTP) et les tensions de vapeur élevées.
Il s'agit d'un partage d'électrons afin de compléter la couche électronique externe des atomes impliqués (voir Structure électronique).
C'est une liaison dirigée : il y a une forte probabilité que les électrons participant à la liaison se trouvent dans la direction formée par le centre de 2 atomes.
C'est une liaison de forte énergie d'où présence d'un cristal compact, de forte cohésion et d'une très grande dureté. Tous les électrons sont localisés et ne sont donc pas conducteur d'électricité.