
I - Expérience avec du chlorure de fer III (FeCl3)
II - Expériences avec du chlorure de sodium (NaCL)
1 ) Préparation de solutions sursaturées
2 ) Croissance des monocristaux
III - Expérience avec du sulfate de cuivre (CuSO4)
Nous avons réalisé des expériences avec quatre produits différents, en les répartissant entre les membres du groupe et elles ont toutes donné un résultat différent. Nous allons ici décrire les démarches effectuées pour chacune de ces expériences et leures résultats.
Tout d'abord, nous avons dissoud le soluté (chlorure de fer III) dans de
l'eau chaude que nous avons continuer de chauffer jusqu'à
saturation. Puis nous avons séparé la
solution obtenue en deux, afin de pouvoir lui faire subir deux
refroidissements différents :
- un refroidissement rapide en plongeant le récipient contenant la solution
dans de l'eau froide
- un refroidissement lent en laissant la solution refroidir normalement sans
intervenir
Laisser refroidir permet qu'il y ai une sursaturation et ainsi amorcer la cristallisation.
Une fois les solutions refroidies à la température ambiante, nous les avons placées près d'un radiateur pour laisser s'évaporer l'eau et permettre aux cristaux de se former et de croître.
Malheureusement, après plusieurs jours, rien ne s'était formé dans le bêcher. Au lieu de cristalliser pendant que l'eau s'évaporait, tout le soluté à recouvert les parois du bécher. Ainsi après que toute l'eau soit évaporée, nous avions du liquide solidifié au fond du bêcher. Il s'agit de cristaux dont la croissance a été désordonnée et qui s'est faite uniquement en longeant les paroies du bêcher ce qui ne donne pas de beaux cristaux.
La seconde série d'expériences que nous avons menée à porté sur les cristaux de sel.
Nous avons décidé d'utiliser plusieurs types de sels différents, et de comparer leur comportement dans le cadre de l'expérience de croissance des cristaux (NaCl pur, sel de cuisine fluoré, sel de cuisine iodé, sel fluoré et iodé, sel non traité contenant un grand nombre d'impuretés).
Le dispositif que nous avons mis en place suit en tout point le protocole expérimental fourni sur ce CD-ROM.
Nous avons dissout tous les types de sels mentionnés ci-dessus l'un après
l'autre, et donc préparé cinq solutions sursaturées différentes. Au bout
d'une journée et demi, nous avons constaté des différences dans les
récipients :
- La solution de sel pur (NaCl pur) présentait quelques beaux petits
cristaux cubiques, fins et clairs.
- La solution de gros sel non raffiné a également donné quelques cristaux
cubiques, mais présentant des irrégulartiés et des défauts notables (stries,
opacité). Un gros amas de microcristaux s'est formé dans le fond,
inutilisables comme cristaux d'ensemencement.
- Les solutions de sel iodé et/ou fluoré ont réagi de la même fašon :
aucun cristal cubique ne s'est formé, juste une sorte de verre opaque et
granuleux, dont je ne pouvais rien tirer pour la suite de l'expérience. Nous
pensons que ce phénomène est lié au fait que l'iode et le fluore ont
influencé l'aspect des cristaux formés, empêchant la croissance de cristaux
cubiques conséquents.
À la suite de cette manipulation et des observations que nous avons pu faire, nous avons séléctionné quelques beaux cristaux de la solution de NaCl pur pour les utiliser en tant que cristaux d'ensemencement.
Contrairement à l'expérience qui suit (sulfate de cuivre), nous n'avons pas réussi à mener à bien cette partie de l'expérience, qui pourtant était la plus intéressante dans le cadre de notre projet de TPE. Cependant nous avons pu observer quelques phénomènes significatifs, et de là tirer des conclusions allant dans le sens des lois de cristallogénèse.
De même que dans la partie précédente, nous avons suivi le protocole expérimental. Nous avons choisi trois beaux cristaux d'ensemencement, que nous avons plongé dans une solution de NaCl pur, dans une solution de sel non raffiné, et dans une solution de sel iodé.
Les premiers résultats sont apparus très rapidement : nous avons pu constater au bout d'à peine quelques heures que dans tous les cas, le fil de nylon se retrouvait incrusté dans le cristal, c'est à dire que les cristaux avaient grossi. Mais des différences sont apparus bien vite : le cristal plongé dans la solution iodée a arrêté de croître au bout d'une nuit. Le deux autres cristaux ont continué de croître un peu mais une erreur de manipulation a fait qu'ils se sont subitement redissout dans la solution. Cependant nous avons eu le temps de les observer assez pour pouvoir les décrire parfaitement.
Le cristal plongé dans la solution de NaCl pur a eut une croissance régulière, nous avons observé un petit cube clair et régulier, sans aucun défaut apparent.
Le cristal plongé dans la solution de sel non raffiné a subit une croissance analogue de celle du cristal précédent, mais sa structure au final était plus imparfaite (striée) et il présentait une coloration grisâtre.
Quant au cristal plongé dans la solution iodée, il a subit une croissance tout à fait originale : en fait ce n'est pas le cristal lui-même qui a grossi, mais plutôt un empilement de cristaux parfaitement symétriques qui s'est collé à sa surface. Encore une fois, nous attribuons ce phénomène à la présence de l'iode : le sel iodé n'a pas pû se déposer dans la continuité du monocristal de NaCl pur car sa structure et donc ses propriétés de cristal ionique (liaisons…) ont été modifiées, et sont donc devenues incompatibles avec du NaCl pur.
Nous avons débuté l'expérience en saturant de l'eau en sulfate de cuivre à température ambiante. Puis nous avons chauffé la solution au bain-marie. Étant donné que la solubilité augmente avec la température, nous avons pu rajouter du soluté (sulfate de cuivre) jusqu'à saturation.

Nous avons ensuite retiré la solution du bain-marie et laissé refroidir. Un fil a été plongé à la verticale dans la solution pour qu'un cristal puisse se former dessus et commencer à croître.

Vingt minutes plus tard environ, voyant que la solution n'avait pas encore commencé à cristalliser, nous l'avons placé près d'une fenêtre de fašon à la refroidir de quelques degrès.
Cette décision a été positive puisque quelques heures plus tard, un
cristal commenšait à se former suivit d'autres peu de temps après.
Note : Certaines photos sont parfois floues en raison de la taille du
récipient, elles devaient être prises de très près. Mais on distingue tout
de même des zones plus sombres correspondant aux cristaux en formation
(entourées en rouge).

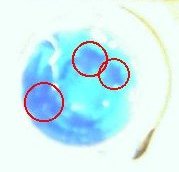
État de la solution trois heures après avoir laissé refroidir
Au fur et à mesure que le temps passe, les cristaux grossissent. Au bout de six heures, quand ils eurent atteint une taille convenable, nous avons déplacé la solution à proximité d'un radiateur pour que le solvant (l'eau) puisse s'évaporer. Pendant cette évaporation, une partie de la solution se solidifie sur les paroies du récipient formant une plaque de sulfate de cuivre qui ne va pas former de gros cristaux. Autour du fil, de très petits cristaux se forment mais de fašon désordonnée et ils ne sont ni beaux, ni gros, ni réguliers.

État de la solution pendant que l'eau s'évapore. On voit distingue plus
nettement les cristaux (qui continuent de croître).
L'eau s'évapore peit à petit. Au bout de deux jours, elle est totalement évaporée. Il ne reste plus dans le récipient que du sulfate de cuivre solide dont une partie forme des cristaux réguliers et lisses.

État de la solution à la fin de l'expérience. Toute l'eau s'est évaporée et
on peut voir des gros cristaux au fond du récipient.